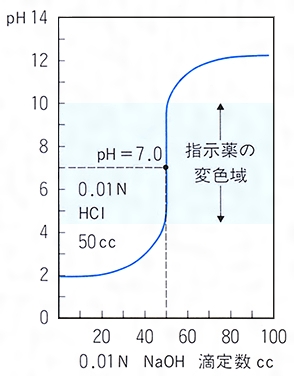
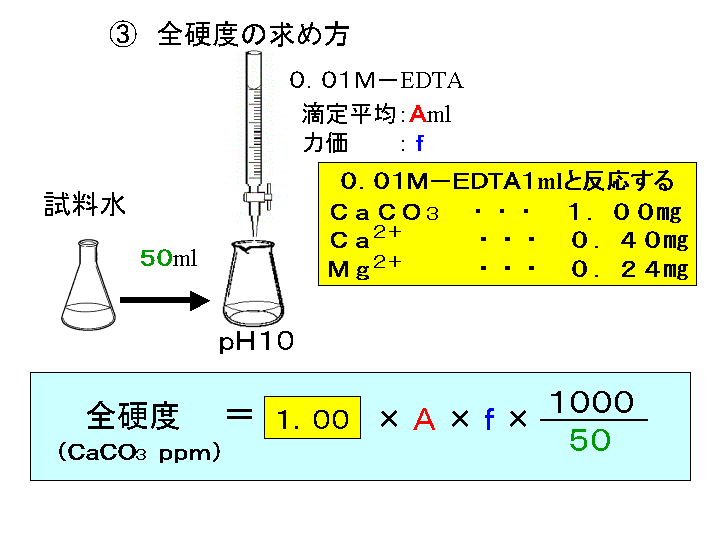
計算式は次のようになります。 滴定曲線例 測定結果 滴定条件例 測定回数 試料量 滴定値 全ニッケル濃度 (mL) (mL) (g/L) 1 1 2 1 3 1 170 平均値 : 1124 g/L 統計計算 標準偏差 : 0376 g/L 変動係数 : 033 %水の全硬度の計算式? キレート滴定でミネラルウォーターに その中で総硬度を求める計算式が2つありますよね。 (1)総硬度=(bf)×1000/試料量 (2)総硬度=(bf-1)×1000/試料量 「水の硬度」というのは、料理に影響を及ぼします。キレート滴定,酸化還元滴定,沈殿滴定の四種類が挙げられる。 3.1.1 酸塩基滴定 酸塩基滴定は中和滴定とも呼ばれ,酸と塩基の中和反応に 基づく滴定方法で各種処理液の酸濃度,アルカリ濃度の分析 に用いる。例として,01 mol/L HCl 10 mL を01 mol/L NaOH
キレート滴定 計算
キレート滴定 計算 マグネシウム
キレート滴定 計算 マグネシウム-⑥ビュレットの0010mol/L EDTA標準溶洷で滴定を行う。溶洷の色が赤紫色から青色に なったところが終点である。 ⑦ ②~⑥を3回繰り返し、滴定値の平均を求める。 4.Ca硬度の測定とMg硬度の計算 キレート滴定の実験で行った水の硬度の求め方について 大学でキレート滴定の実験を行ったんですが水の硬度がうまく計算できなくて教えていただきたいです 大学では アメリカ硬度=検液のモル濃度××1000 ドイツ硬度=検液のモル濃度×5608×1000×(100



キレート滴定の問題で Bt指示薬を使ってcaとmgの混合溶液のmgだけの濃度 Yahoo 知恵袋
キレート滴定法は,金属キレート錯体の生成反応を利用して,金属イオン を定量する方法である。たとえば,水道水など飲料水中に含まれるマグネシ ウムおよびカルシウムイオン濃度,すなわち,水の硬度はedta を用いる キレート滴定によって簡単に測定水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し錯体・キレート 錯体平衡の計算問題を解いてみよう演習問題 ・錯体・キレート平衡の計算問題 その1 というテーマで解説していきます。 錯体・キレート平衡の計算問題 その1演習問題
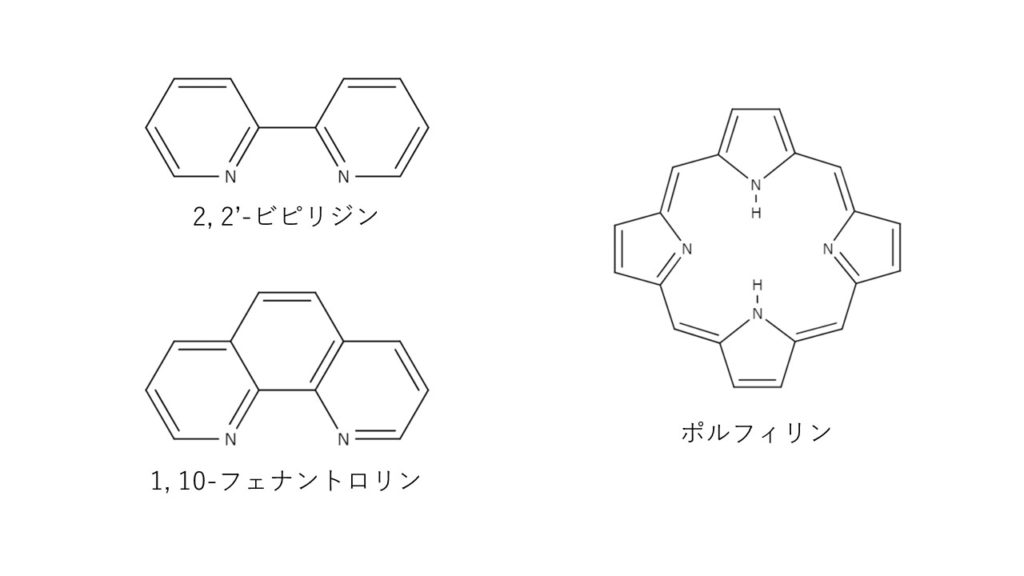
キレート滴定ではpH により試料と滴定試薬との反応性が変化するため、pH 調節は規定通り 上記の計算式で、カルシウム、マグネシウムの合量およびカルシウム濃度を算出します。 合量とカルシウム濃度との差がマグネシウム濃度に対応します。キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。
キレート滴定の諸問題と, 石灰石, ドロマイト露頭における化学成分の変動について 藤貫 正 , 藤谷 吉三 著者情報 藤貫 正 通商産業省地質調査所化学課 藤谷 吉三 通商産業省地質調査所化学課 ジャーナル フリー 1966 年 1966 巻 号 pキレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。キレート滴定の基礎(Ⅰ) キレート滴定の基礎(Ⅰ) 天 満 照 郎※ 1 はしがき キレート滴定法が創始されてから 年,多くの金属の 定量に利用され,その有用性は増大の一途をたどってい る。edta のような優れたキレート化剤が安価に入手で



滴定とは コトバンク




キレート滴定 Yakugaku Lab
水の硬度測定 1 はじめに 硬度 1) とは,水に含まれるCa 2 とMg 2 の量を表す指標であり,この値に基づいて軟水や硬水 2) といった水の硬さが決められている。 軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターを各種滴定・イオン交換法 担当:反応分析化学 竹原takehara@chemkyushu公 24 電位差滴定法 担当:錯体物性化学 越山 @mboxnckyushu友美 42 第2分冊 九州大学理学部化 (1)前提知識・関連事項 ①塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象) ②酸と塩基、中和知識テスト ③中和の計算(逆滴定、食酢の濃度の問題も解説しています) (2)解説動画 ☆より学習効率を上げるために "塩の水溶液の液性(硫酸水素カリウムの水溶液の液



2




キレート滴定法 改訂 旧版 上野景平 明倫館書店 古本 中古本 古書籍の通販は 日本の古本屋 日本の古本屋
4.キレート滴定 41 001Medta標準溶液の調製 要点 キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム 塩h2na2y・2h2oでetaと表示されている。この試薬は結晶水以外に多少の水分を含んで鉛イオン(Pb2)の定量法としては、一般にキレート滴定が広く活用されています。鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域で(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。




04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse




アンモニア アミン類 配位結合 結合を形成する2つの原子の一方からのみ結合電子が分子軌道に提供される化学結合 Ppt Download
キレート滴定の実験で行った水の硬度の求め方について 大学でキレート滴定の実験を行ったんですが水の硬度がうまく計算できなくて教えていただきたいです 大学では アメリカ硬度=検液のモル濃度××1000 ドイツ硬度=検液のモル濃度×5608×1000×(100となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが程式をもとに計算して作成された Kielland の表2)を用 いて(3)式から求めることができる。しかし,実際の 8 キレート滴定において溶液のイオン強度が 01 以下で
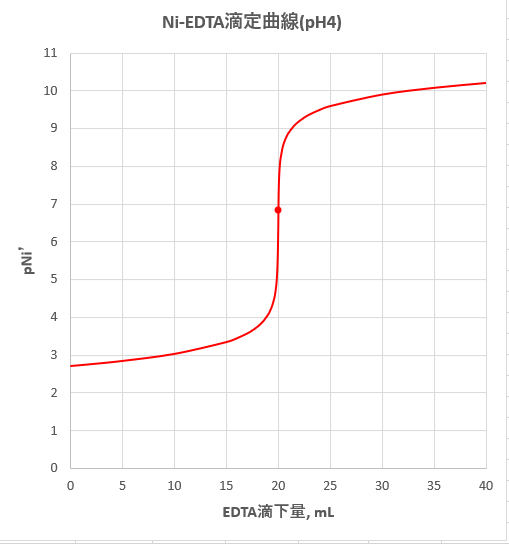



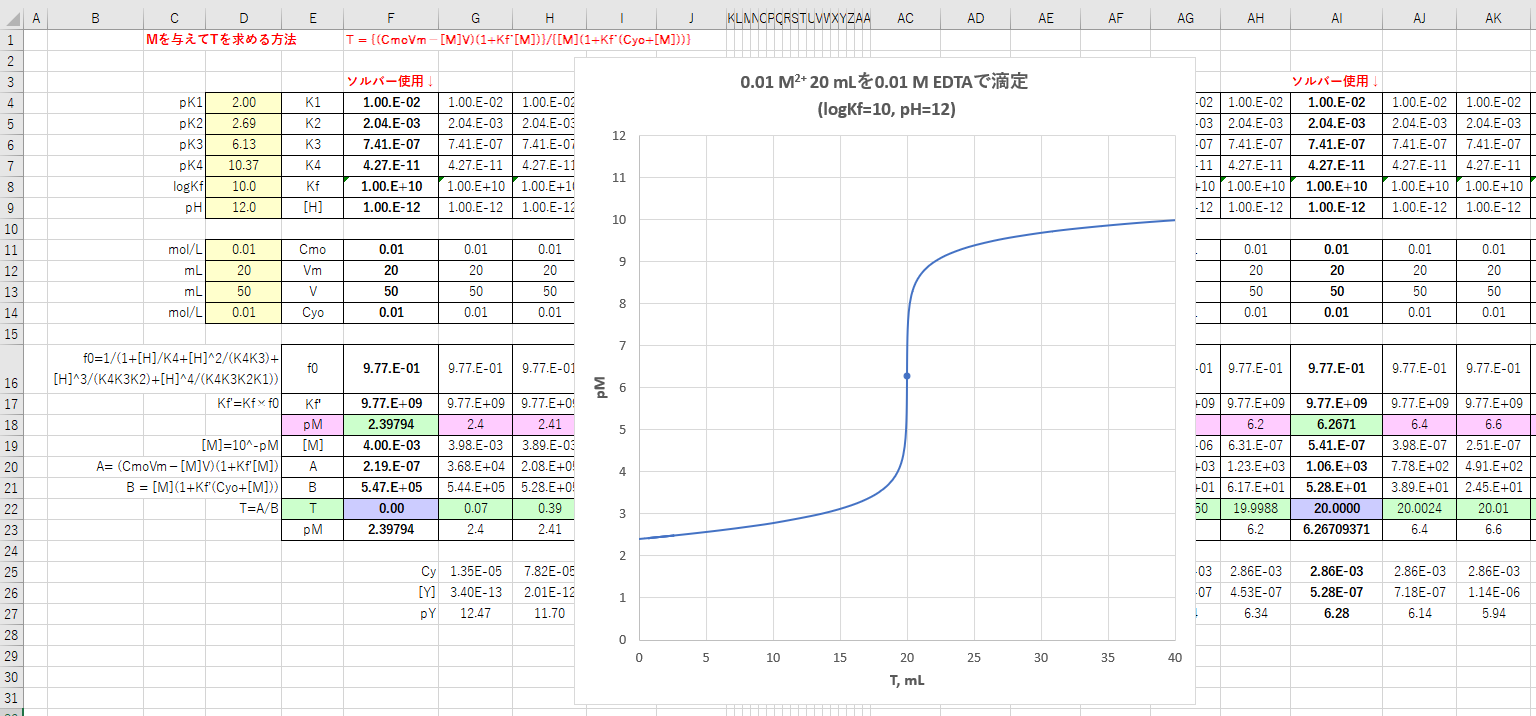
Edta 滴定曲線 溶解度などーエクセルを用いて




04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse
キレート滴定キレートてきてい 試料物質(主として金属イオン)が適当なキレート試薬と反応して キレート化合物 を生成することを利用した滴定法。 1945年Gシュワルツェンバハが創始。 代表的なキレート試薬としては エチレンジアミン 四酢酸ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。京都大学 全学共通教育 基礎化学実験ホームページ:http//wwwchemzenkyohkyotouacjp/化学実験操作法:操作法 2 4 キレート



キレート滴定 計算




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog
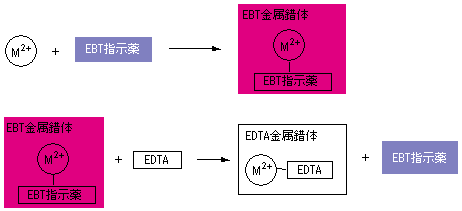
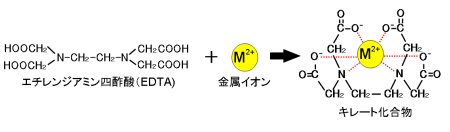
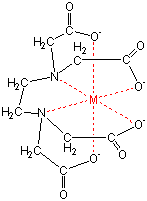
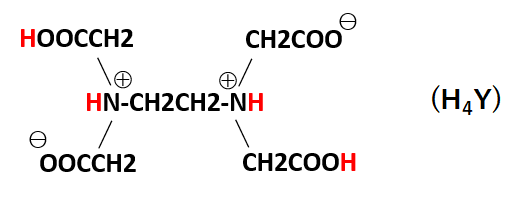
キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定に注意を払う必要がキレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



キレート滴定
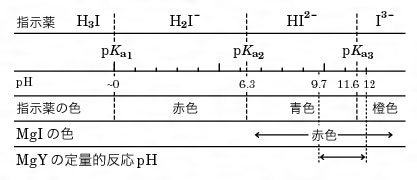
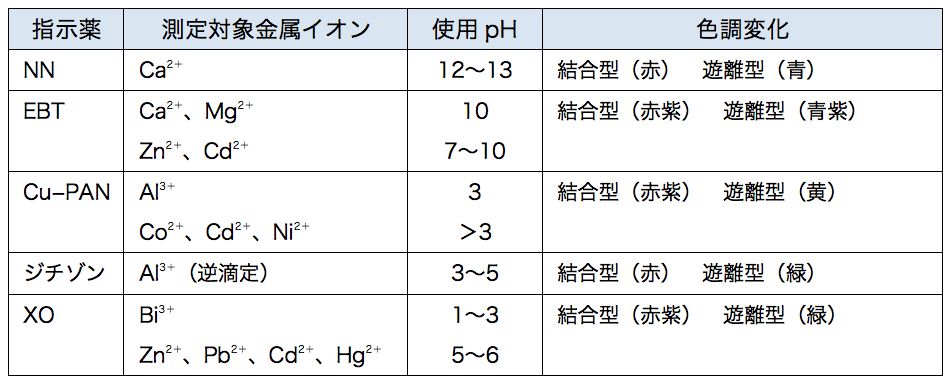
XIII6 キレート滴定法各論 局方で用いられているキレート滴定治の例(教科書 p168 、表 5・3・3): *計算上は上限の pH が下限の pH より小さいが、実際には pH10 〜11 で滴定する。 指示質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建



キレート滴定の問題で Bt指示薬を使ってcaとmgの混合溶液のmgだけの濃度 Yahoo 知恵袋



2
水道水の総硬度測定はキレート滴定(光度検出)で行います。 ⑥ EBT指示薬溶液0.5mlを加え、0.01mol/L-EDTA溶液で滴定します。(赤→青) 計算式24ア ルミニウムのキレート滴定 キレート試薬を用いて、滴定法により金属イオンの定量を行う操作をキレート滴定と言う。 アルミニウムのキレート滴定では、キレート試薬としてエチレンジアミン四酢酸・ニナトリ ウム塩(edta・2na塩 と略す)を 使用する。キレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平



薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量
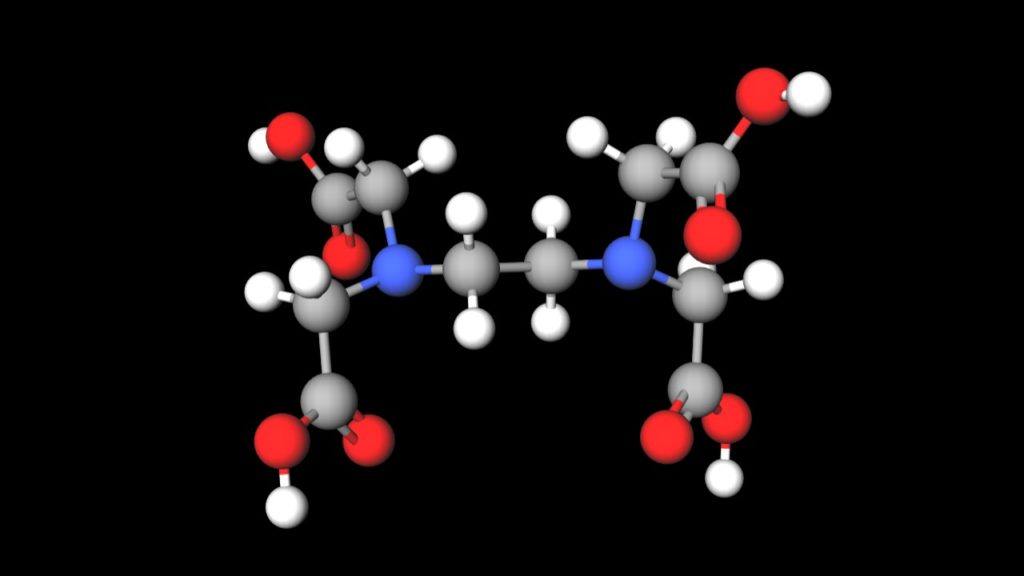
‒ 133 ‒ キレート滴定シミュレーションのインターネットによる自動サービス 芦 田 実 埼玉大学教育学部理科教育講座 村 田 龍 一 株式会社ワクシス・エンタープライズ 長 岡 淳 子 首都大学東京大学院社会科学研究科 キーワード:定量分析、キレート滴定、濃度計算、遠隔支援キレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。



2




札幌校 チャンスはこの夏 夏期講座 Zoom配信 薬剤師国家試験対策予備校 ファーマプロダクト



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ



水の硬度測定



キレート滴定とは コトバンク




キレート滴定 Yakugaku Lab



2



Www2 Ube K Ac Jp



化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋



Edtaを用いた硬度計算の問題があります カルシウムイオン マグ Yahoo 知恵袋




17 号 可搬型滴定装置 Astamuse




02 1090号 架橋錯体含有潤滑剤 Astamuse




1000以上 キレート滴定 計算 銅 キレート滴定 計算 銅




キレート滴定



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて
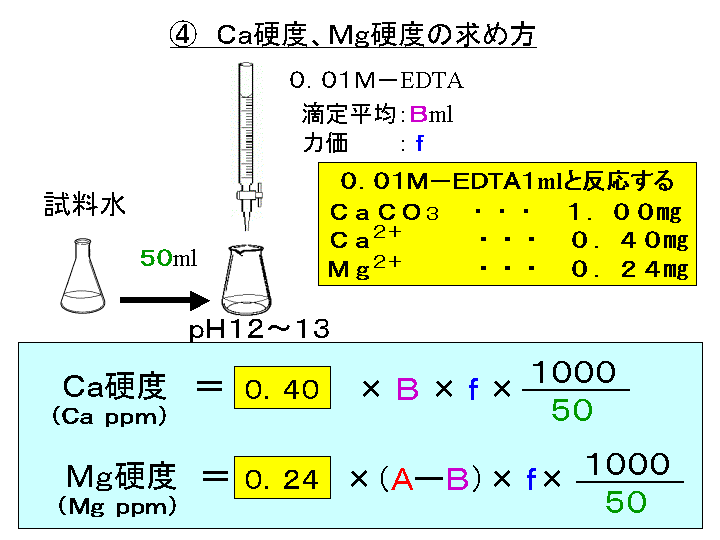



水の硬度測定 キレート滴定



2



2
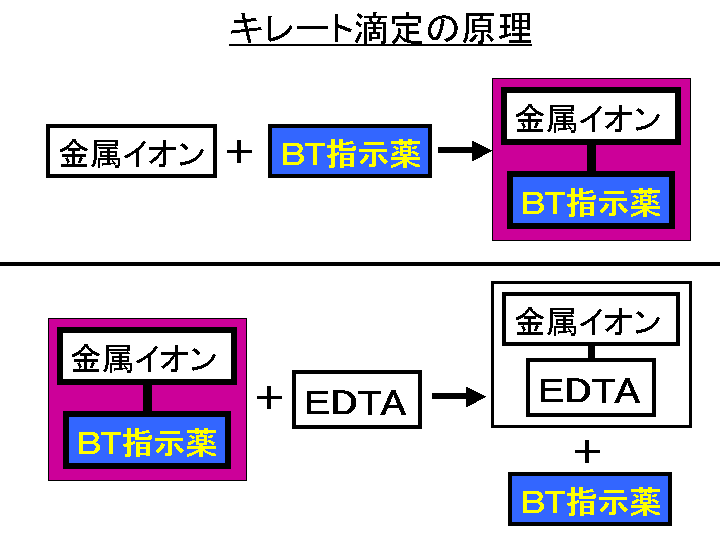



水の硬度測定 キレート滴定



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋



キレート滴定




キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com




分析実務たん 紫杏 数式を書くのが面倒なので手書きで



質問箱



キレート滴定 Yakugaku Lab




キレート滴定



2




ミネラル サプリ キレート 滴定
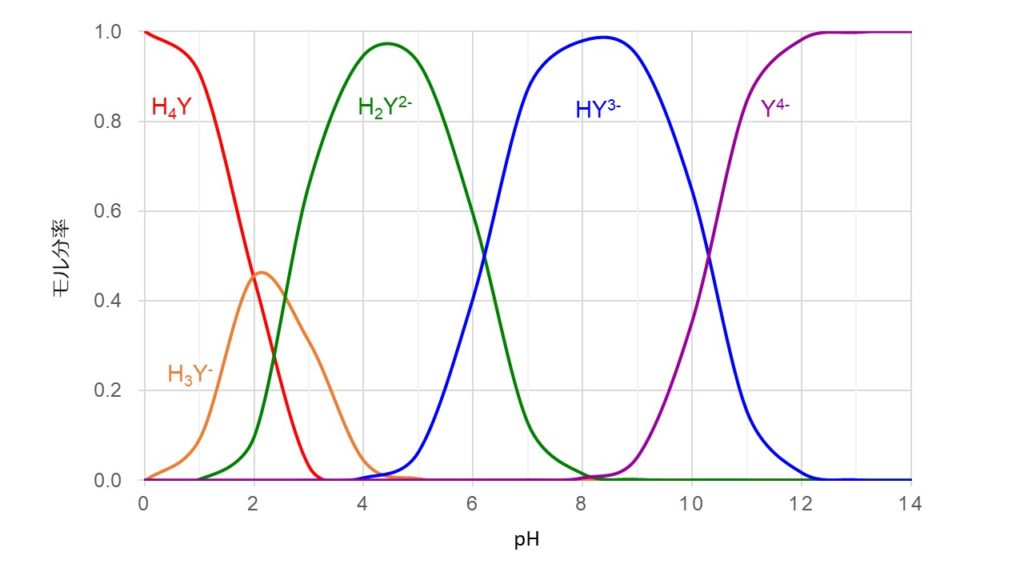



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com
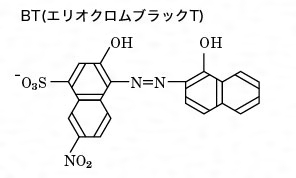



キレート滴定とは コトバンク




工業化学科実習風景 キレート滴定法 Youtube



2
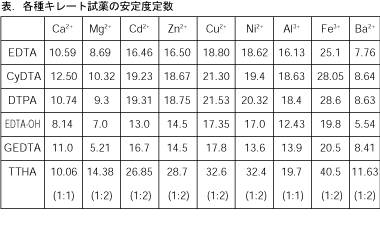



Column




キレート滴定法 改稿新版 上野景平 明倫館書店 古本 中古本 古書籍の通販は 日本の古本屋 日本の古本屋




キレート滴定14



キレート滴定
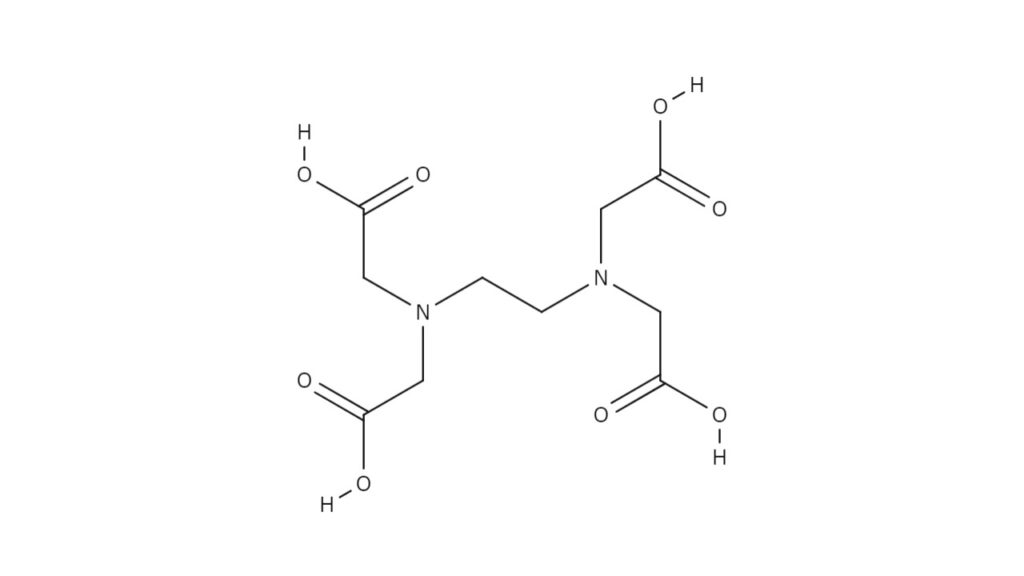



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



水の硬度測定 キレート滴定



水の硬度測定



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com




大学の 水の分析実験 なんとなく実験しています



1




04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse



2



キレート滴定 Yakugaku Lab




最も欲しかった キレート滴定 考察 書き方 キレート滴定 考察 書き方 Mbaheblogjpmvvo




滴定計算 滴定についてよくある質問 定義 モル濃度方程式 曲 Lorett



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



1
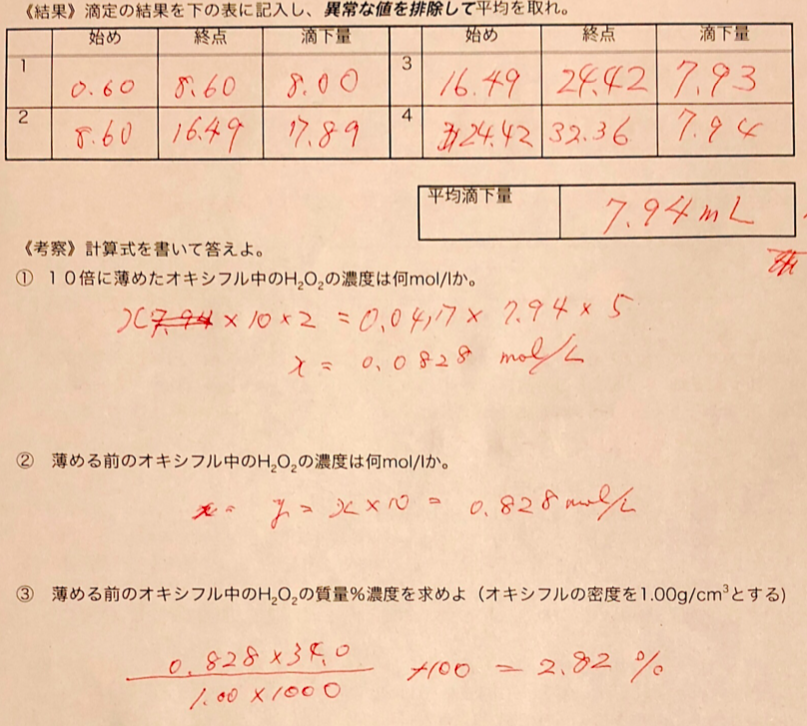



上 キレート滴定 考察 キレート滴定 カルシウム 考察
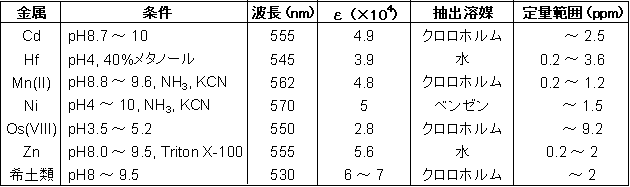



比色試薬 金属指示薬 Pan 同仁化学研究所




04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




水の硬度測定 キレート滴定




京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube




滴定計算 滴定についてよくある質問 定義 モル濃度方程式 曲 Lorett




書籍紹介 分析化学の基礎 木村 優 中島理一郎 共著 化学




キレート滴定14



年11月発行 カルシウム塩のキレート滴定について




演習誰でもできる化学濃度計算 実験 実習の基礎 通販 セブンネットショッピング




キレート滴定 Yakugaku Lab




キレート滴定
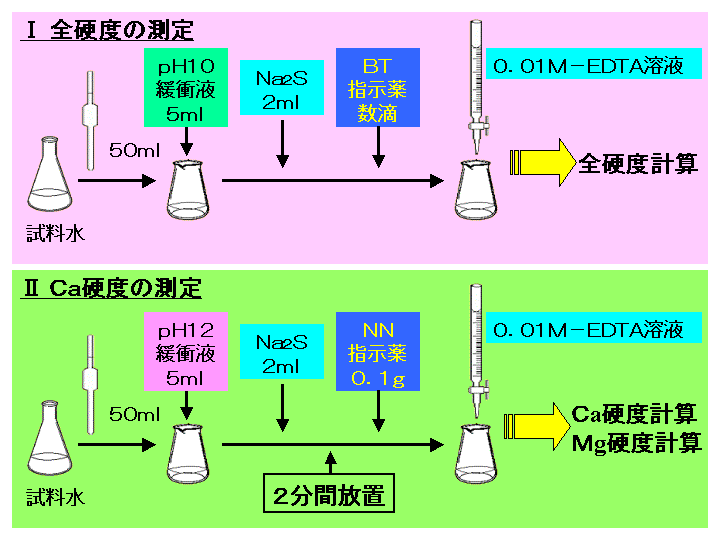



水の硬度測定 キレート滴定



硬度の計算方法を教えてください 水1l中にcaが16mg Mgが Yahoo 知恵袋
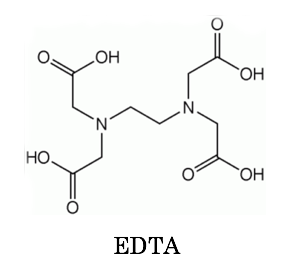



キレート滴定 Yakugaku Lab



Hakodate Ct Ac Jp



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



水の硬度測定 キレート滴定
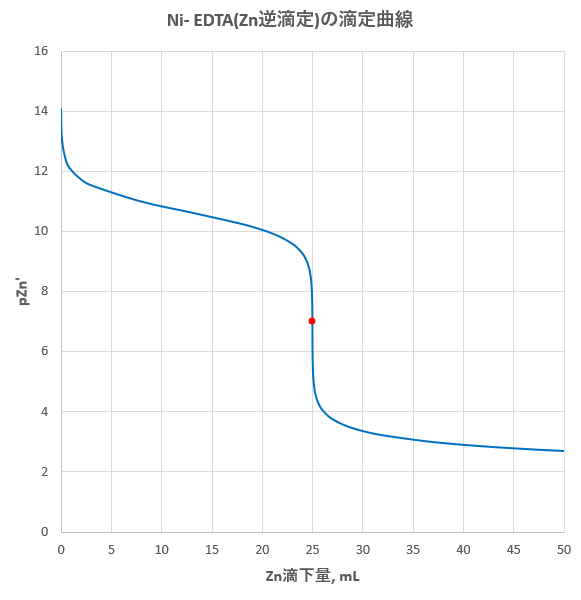



Edta 滴定曲線 溶解度などーエクセルを用いて



2



Asahikawa Nct Ac Jp
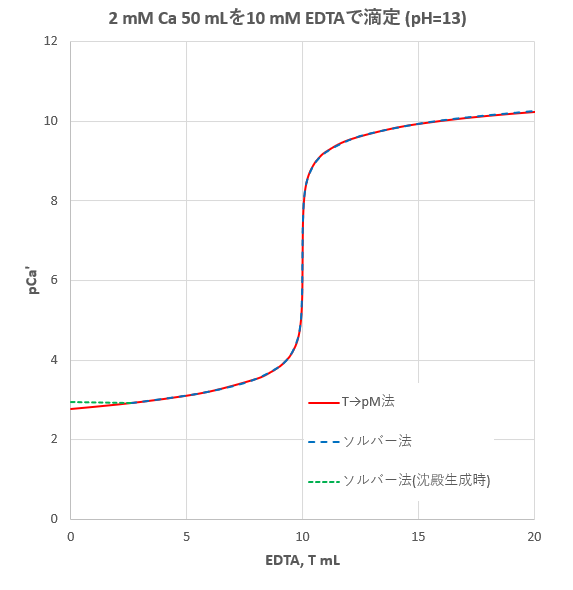



カルシウムのedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




Rec Realeducationcompany 皆さんこんにちは Rec レック です 先週に引き続き 過去の国家試験を分析した上で出題頻度の高い内容や 103回国家試験で出題されそうな内容を発信していきます 本日は 定量分析から 化学的定量法 に関して103回国家試験で出題



キレート滴定の問題です よろしくお願いします Yahoo 知恵袋




比色試薬 金属指示薬 Pan 同仁化学研究所



キレート滴定で水の中のカルシウムイオンの定量を調べる実験 Yahoo 知恵袋
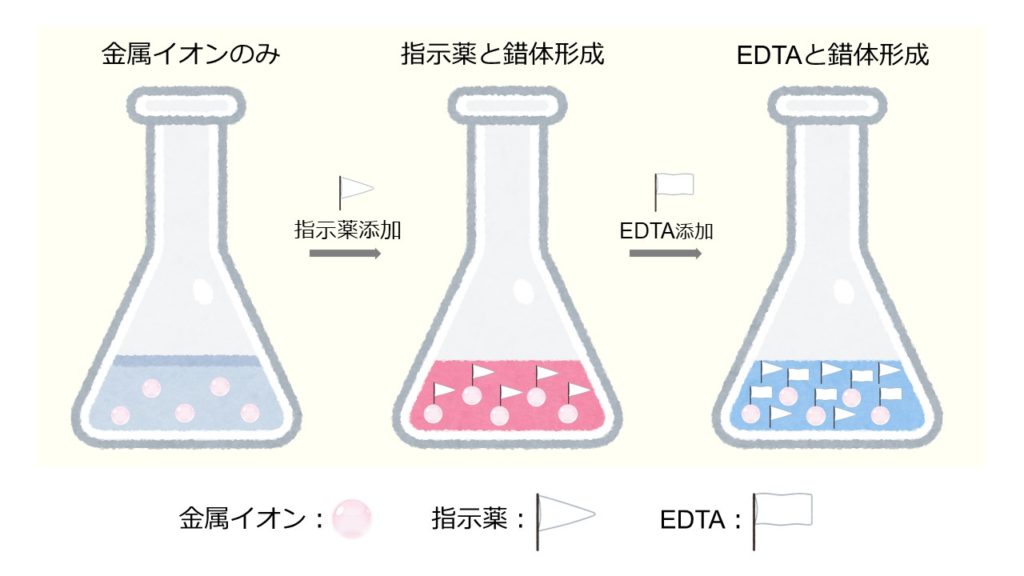



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



水の分析
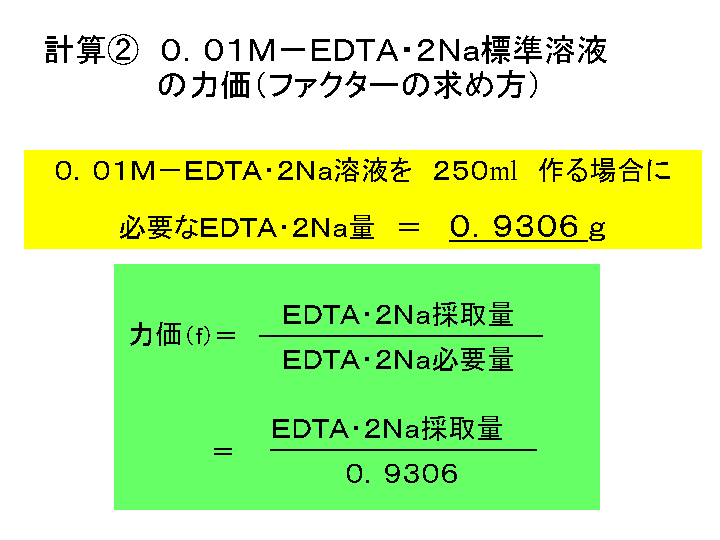



水の硬度測定 キレート滴定




キレート滴定




キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス




キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス




灰中の酸化カルシウム



Ibaraki Ct Ac Jp




キレート滴定 Yakugaku Lab



2
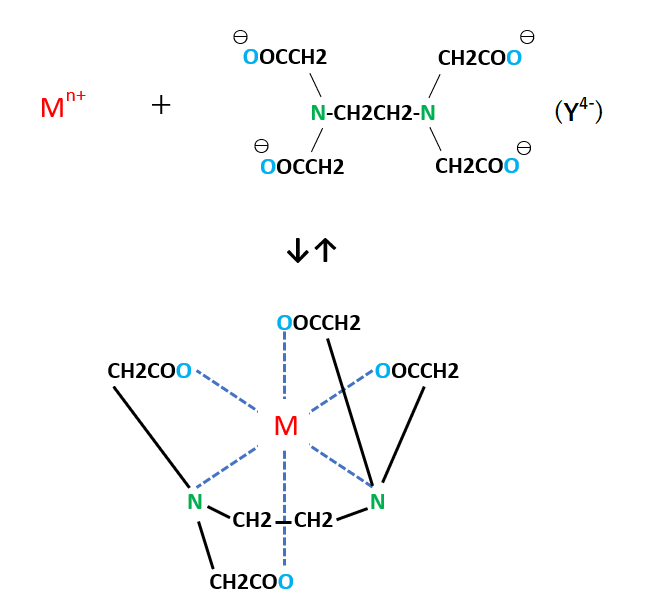



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



0 件のコメント:
コメントを投稿